Ein häufiges Reaktionsprinzip in der organischen Chemie:
Mehrere Bindungen der organischen Chemie entstehen durch den gleichen Mechanismus, die Kondensationsreaktion:
R-OH trifft auf HO-R . Es entsteht R-O-R . Dabei spaltet sich H-O-H, also Wasser H2O, ab. Wir bauen diese gleiche Kondensationsreaktion in Modellen für drei verschiedene Molekül-Duette:
1. Die Etherbindung erzeugt Ether. Da trifft eine Hydroxylgruppe auf eine andere. Also ein Alkohol und ein zweiter verschmelzen bei einer Kondensationsreaktion.
Notieren Sie als chemische Reaktion auf Papier und bauen Sie im Modell ein Beispiel: Dimethylether, Methyl-Ethyl-Ether oder Diethylether (das ist der klassische „Äther“).
Diese „Veretherung“ tritt auch auf zwischen Zuckermolekülen. Also wenn z.B. aus Glucose Stärke wird. Das Ergebnis heißt da „glykosidische Bindung“.
2. Die Esterbindung erzeugt Ester. Da trifft eine Hydroxylgruppe auf eine Carboxylgruppe (das ist die funktionelle Gruppe bei Carbonsäuren = Alkansäuren).
Notieren Sie als chemische Reaktion auf Papier und bauen Sie im Modell ein Beispiel:
Dimethylester, Methyl-Ethyl-Ester oder Dieethylester.
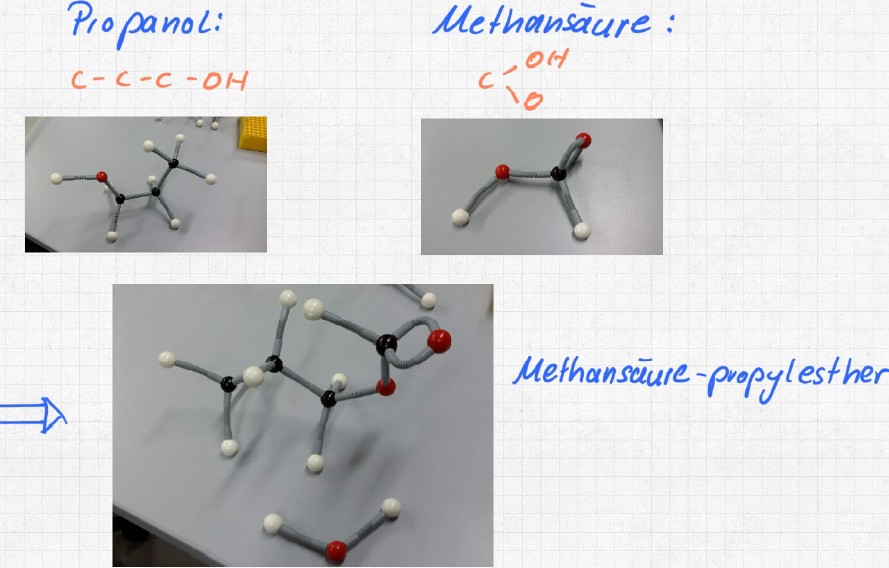
Eine Veresterung findet auch statt beim Aufbau der Fette: Drei längerkettige Alkansäuren („Fettsäuren“) verbinden sich mit je einer der drei Hydroxylgruppen von Glycerin.
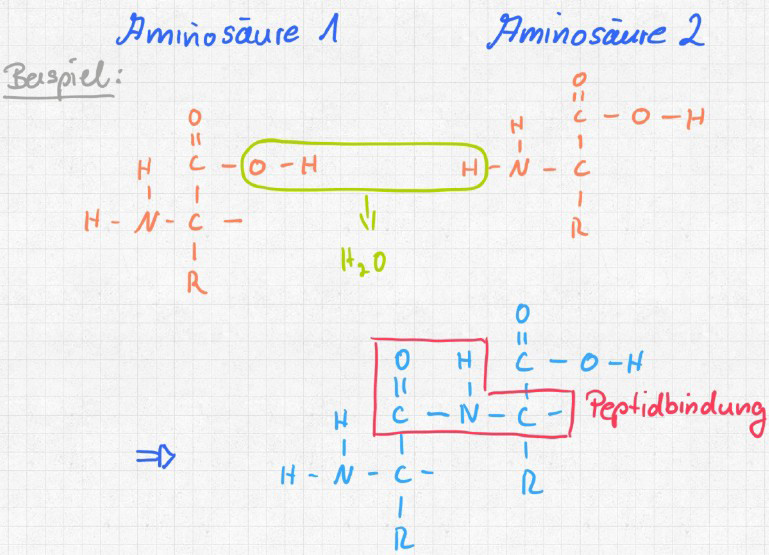
3. Die Peptidbindung erzeugt in der Welt der Kunststoffe die Polyamide. In der Biologie entstehen mit dieser Bindung aus einzelnen Aminosäuren Polypeptide. Ab 100 Peptidbindungen zwischen Aminosäuren spricht man von Proteinen.
Da trifft eine Carboxylgruppe auf eine Aminogruppe. Wir bauen gemeinsam drei Moleküle und lassen sie in Kondensationsreaktion zur Peptidbindung reagieren: Ein Diamin, eine Dicarbonsäure und eine Aminosäure (da ist im gleichen Molekül an einer Stelle eine Aminogruppe, an einer anderen Stelle eine Carboxylgruppe).

4. Vielfache Kondensationsreaktionen heißen in der Kunststoffchemie Polykondensation. Sie spielen eine Rolle bei Polyolen, Polyestern, Polycarbonaten und Phenoplasten.
5. Hinweis auf ein Begriffsproblem: In der Physik bedeutet „Kondensation“, dass ein Gas sich verflüssigt. Das hat mit der chemischen Kondensationsreaktion nichts zu tun.
6. Die Kondensationsreaktion findet theoretisch von selbst statt, wenn man die Stoffe mischt. Sie ist also meistens exotherm. Ohne Katalysator braucht sie aber oft Tage, Monate, gar Jahre. In der Praxis wird sie katalytisch herbeigeführt.
Die Umkehrung der Kondensationsreaktion heißt Hydrolyse. Sie ist meistens endotherm und läuft nicht von selbst ab. Sie findet aber z.B. im Stoffwechsel von Lebewesen durch chemische Tricks ständig statt. Beispiele für Hydrolysen sind der Abbau von Stärke in der Pflanze, dem der Abbau von Glykogen im Tier entspricht. Auch bei der Nutzung von Fettreserven werden die Fettsäuren aus dem Glycerin-Tri-Ester hydrolytisch abgespalten.
Der Trick ist ein Katalysator, der kleine Anteile des vorhandenen Stoffes hydrolysiert. Diese kleine Menge wird sofort weiter verarbeitet. Dadurch fehlt im Reaktionsgleichge- wicht die kleine Menge - und wird nachgebildet. Das wird wieder weiter verarbeitet....