Organische Chemie, Allgemeines
Im organischen Molekül steckt immer C =
Kohlenstoff .
„Anorganisch“ sind Kleinmoleküle wie CO2,
CO, CS2 ![]() , H2CO3
(Kohlensäure)
, H2CO3
(Kohlensäure) 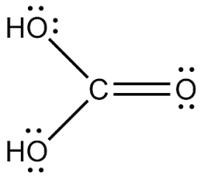 ...soeben
das war die Strukturformel von Kohlensäure. Hier folgt ein räumliches Modell der
Kohlensäure:
...soeben
das war die Strukturformel von Kohlensäure. Hier folgt ein räumliches Modell der
Kohlensäure: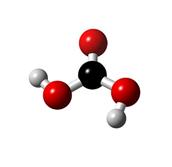 .
Anorganisch ist C auch in Steinen (Carbonate) und natürlich pur als Kohle.
.
Anorganisch ist C auch in Steinen (Carbonate) und natürlich pur als Kohle.
Bindungspartner des C: Da
gibt es zunächst zu 99 % H
= Wasserstoff 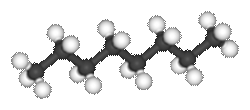 Links
ein räumliches Modell von Oktan, dem Idealstoff im Benzin: Acht C, achtzehn H.
Ein organisches Molekül ohne H ist eine Ausnahme, z.B. „Teflon“:
Links
ein räumliches Modell von Oktan, dem Idealstoff im Benzin: Acht C, achtzehn H.
Ein organisches Molekül ohne H ist eine Ausnahme, z.B. „Teflon“: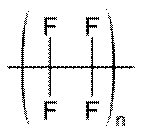
Als nächsthäufigen Bindungspartner gibt es
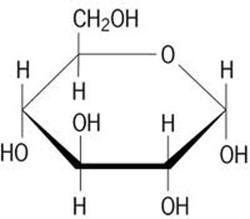
zu 60 % O = Sauerstoff. Hier sehen wir die ringförmige Strukturformel des
Zuckers "Glucose": 6 H, 12 C und 6 O-Atome
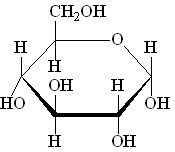
Der dritthäufigste Bindungspartner des C ist
zu 10 % N = Stickstoff. Z.B. in Proteinen kommt er vor:
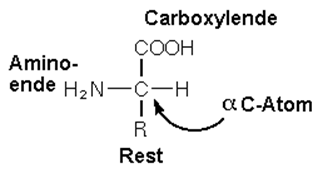
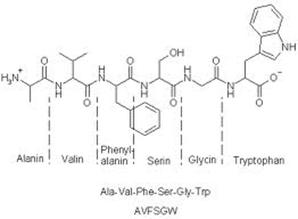
Schließlich tauchen als Bindungspartner
zu 1 % S, Halogene (=F, Cl, Br, J) auf.
....................................
C hat in der organischen Chemie immer Atombindungen: _____ (Striche, in Lewis-Formel darstellbar)
(es gibt ansonsten noch Salzbindungen mit Ladungszusammenhalt durch Ionen, sowie Metallbindungen – zwischen Metallen gibt es keine feststehenden Bindungsanzahlen)
C hat immer 4 Atombindungen:
4 Einfachbindungen bei Methan 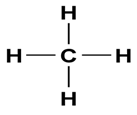
1 Doppelbindung und 2 Einfachbindungen bei Formaldehyd 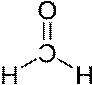
1 Dreifachbindung und 1 Einfachbindung bei Alkinen und Cyanaten:
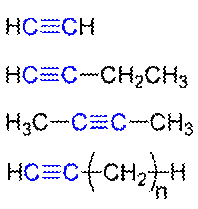
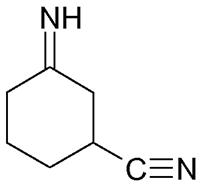
Typisch für organische Moleküle (und die andern Elemente außer C schaffen das seltener und sind dann zerbrechlicher) sind Ketten und Ringe:
Beispiel „ideales Benzin“ = Oktan:
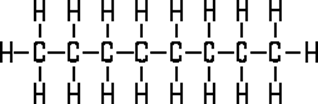 (das hier ist die Strukturformel. Oktan im räumlichen Modell hatten wir
schon weiter oben auf dieser Seite)
(das hier ist die Strukturformel. Oktan im räumlichen Modell hatten wir
schon weiter oben auf dieser Seite)
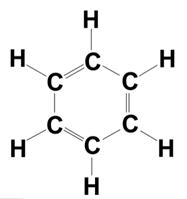
Beispiel Benzol:
Beispiel Glucose (mit O im Ring):
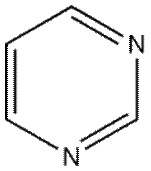
und Pyrimidin (N im Ring):