Aldehyde
|
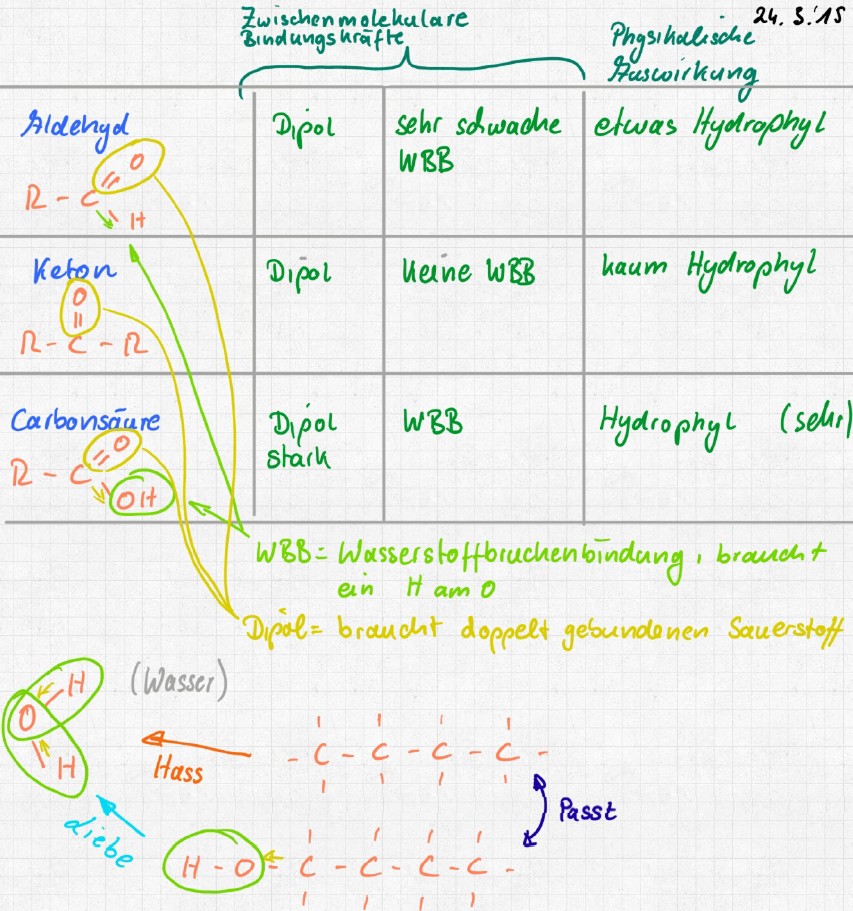
Die Aldehyde bilden eine homologe Reihe (Was ist das?). Ihre Name bedeutet „alcohol dehydrogenatus“ - „Alkohol nach Verlust von zwei Wasserstoff-Atomen“. Summenformel der Aldehyde: CnH2n+1CHO (n = 0, 1, 2, 3, 4, …) Zwischen den Aldehydgruppen von Alkanalen kommt es zu Dipol-Dipol-Kräften, da die C=O-Doppelbindung sehr polar ist. Wasserstoffbrückenbindungen bilden sich nicht, weil kein sauerstoffgebundenes Wasserstoffatom vorhanden ist. Deswegen liegen die Siedepunkte der Aldehyde zwischen denen der Alkohole und Alkane. Aldehyde sind als Aromastoffe in Lebensmitteln weit verbreitet. Hexanal findet sich z. B. in Äpfeln, Birnen, Pfirsichen und in der Kirsche. (zeichnen Sie mal Hexanal) |
In der Chemie ist Formaldehyd eine Allzweckwaffe: - Man kann biologische Präparate für Jahrhunderte darin konservieren, denn Formaldehyd kann Wasser in totem Gewebe ersetzen und tötet aber alle Kleinlebewesen. - Man stellt Kunststoffe damit her („Kondensationsreaktion“) - Man löst Kunststoffe in Formaldehyd, presst sie in die gewünschte Form und lässt das Formaldehyd wieder herausdampfen. „Pressspanplatten“ und andere Produkte, die so hergestellt wurden, müssen deshalb eine gesetzlich vorgeschriebene Frist in der Fabrik zum Ausdampfen lagern, bevor sie ausgeliefert werden. |
Aldehyde haben am C-Atom zwar ein Sauerstoff-Atom, aber es ist ohne Wasserstoff-Atom. Aldehyde können sich dadurch eher auch in unpolaren Stoffen lösen und sind nicht so mischbar mit Wasser wie Alkanole und Carbonsäuren. Die Aldehyd-Gruppe ist ein Dipol, hat aber keine Wasserstoffbrückenbindungen. Wir vergleichen: