Diana: Was ist für den Chemiker eine Lösung?
| Eine Lösung ist ein Gemisch
aus mindestens zwei chemisch reinen Stoffen, die sich homogen miteinander
vermischen.
Es gibt in einer Lösung das Lösungsmittel und den
darin gelösten Stoff. Man sagt hier, dass das Kochsalz sich gelöst hat. Es liegt in Form einer Lösung vor, die sogenannte Kochsalzlösung. Dies ist ein Stoff mit neuen chemischen Eigenschaften. Er hat zum Beispiel eine andere Siedetemperatur als Wasser oder Salz. Bei diesem Lösungsvorgang werden die Moleküle oder
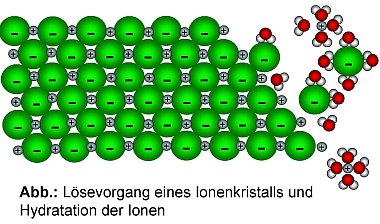
Ionen aus dem Gitterverband des Feststoffes (NaCl) gelöst.
|
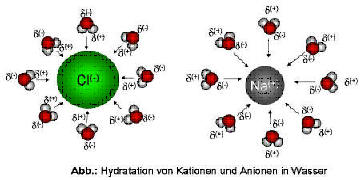
Die aus dem Ionenverband (Salzgitter) gelösten Teilchen treten dann, mit den entgegengesetzt geladenen Enden der Wasserdipole in Wechselwirkung. Die gelösten Ionen werden mit mehreren Wassermolekülen umlagert, wobei Energie frei wird. Man bezeichnet diesen Vorgang auch als Hydration und die freigesetzte Energie als Hydrationsenergie. Lösungseigenschaften des Wassers sind
stoffspezifisch (d.h. vom zu lösendem Stoffabhängig). Aber auch
Temperaturabhängig: einige Stoffe lassen sich gut, mäßig oder gar schlecht
bei Raumtemperatur lösen. Außer vielen weiteren Feststoffen löst Wasser auch Flüssigkeiten und Gase. Dies zeigen beispielsweise alkoholische Getränke und Sprudel. Andere Stoffe wie Fette, Öle und Lacke
kann man nicht in Wasser lösen.
|