Experimente der "Farb-Gruppe"
1. Chromatogramm von Chlorophyll
Vorbereitung:
Suchen Sie in der Umgebung weiche grüne Blätter oder bringen Sie welche
von zuhause mit. Das können Blätter von Zimmerpflanzen, Spinat, Laubblätter oder
auch Gras sein. Spinat ist angeblich am ergiebigsten. Sie können bei Interesse
mehrere Chromatografien mit grünen Pflanzenteilen nebeneinander starten.
Bereiten Sie zuerst mehrere Chromatografiestreifen vor. Eigentlich sollte
es das Papier käuflichen Kieselgurstreifen bestehen - ca. 2 cm breit und 10 cm
hoch. Wir können es aber auch mit gleich großen Löschpapierstreifen versuchen.
Auf den Chromatografiestreifen sollten Sie auf der Seite, die "unten" ist, in 2
cm Höhe eine Markierung seitlich einzeichnen.
Stellen Sie nun die Chromatografiekammer bereit. Im einfachen Fall ist
die Chromatografiekammer ein großes Reagenzglas. Das Laufmittel besteht aus
Cyclohexan und Aceton im Verhältnis 70:30. Die Chromatografiekammer muss außer
beim Hineingeben von Flüssigkeit und Papier stets mit einem Stopfen verschlossen
sein.
Nehmen Sie einen Mörser mit Pistill und stellen Sie Aceton bereit.
Eine Pipette mit möglichst dünner Spitze sollte bereitliegen, ebenso ein
Draht, z.B. von einer aufgebogenen Büroklammer.
Aceton verdunstet sehr schnell. Bitte verschließen Sie den
Acetonbehälter stets nach einer Entnahme.
Durchführung:
Grüne Blätter werden zerkleinert. Dabei gibt man als Extraktionsmittel immer so
viel Aceton zu, dass ein wenig Flüssigkeit im Mörser zu sehen ist. Zum wirksamen
Zerkleinern ist Sand im Mörser hilfreich. Den Sand holen Sie sich von der
Kohlenhydratgruppe. Wenn das Aceton sehr grün gefärbt ist,
wird die Lösung filtriert. Zum Filtrieren gibt man ein Filterpapier in einen
Trichter und setzt diesen auf ein Reagenzglas in einem Reagenzglasständer.
Nun füllt man eine Chromatografiekammer etwa einen Zentimeter hoch mit dem
Laufmittel Cyclohexan / Aceton.
Jetzt holen Sie mit der Pipette, in einem andern Versuchsdurchgang mit einem
Draht eine kleine Menge Chlorophyll-Extrakt aus dem Mörser. Es geht darum, einen
möglichst dünnen und doch farbintensiven Strich mit dem Erstrakt in Höhe der
2-cm-Markierung quer über das Chromatografiepapier zu ziehen. Das muss ein
paarmal geübt werden.
Nun geben Sie sofort das Chromatogrfiepapier in die Chromatografiekammer und
warten. Je nach Art des Chromatografiepapiers kann das Warten zehn Minuten bis
zwei Stunden dauern. Es geht darum, die Bestandteile des Chlorophylls sichtbar
und doch gut voneinander getrennt über das Paper wandern zu lassen. Sie können nach etwa 5 cm Steighöhe des Extraktes im Papier schon stoppen,
weil die Farben sonst zu blass werden, oder
erst, wenn fast der obere Rand des Chromatografiepapiers erreicht ist.
Nehmen Sie das Chromatografiepapier heraus und kennzeichnen Sie mit einem
seitlichen Punkt die Stellen, an denen Sie Farben sehen. Die Farben bleichen
teilweise oder verschwinden beim Trocknen. Sie sollten bald ein Foto machen.
Der Klasse sollten Sie eine Chromatografiekammer in Aktion zeigen können, also
mit etwa bis zur Hälfte gestiegenen Chlorophyll-Bestandteilen, sowie gelungene
fertige Chromatografien von Chlorophyll.
In absteigender Reihenfolge sollte man finden: Carotin (orangegelb), Chlorophyll a (blaugrün), Chlorophyll b (olivgrün) und Xanthophyll (gelb). Diese Reihenfolge entspricht zunehmender Polarität (Carotin ist ein unpolarer Kohlenwasserstoff).
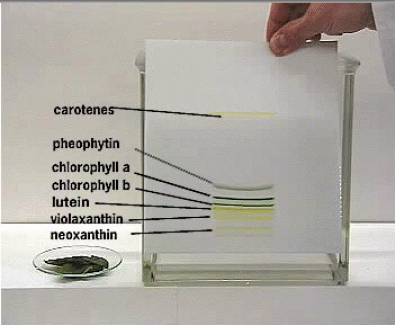
http://www.chemie.fu-berlin.de/medi/suppl/chlorophyll.html
2. Chromatogramm aus Tinte
Zunächst schneiden wir das
Filterpapier in etwa 3 cm breite Streifen. Diese falten wir an einem Ende etwas,
um ihn mit einer Büroklammer am Holzstäbchen befestigen zu können. Dann ziehen
wir mit dem jeweiligen wasserlöslichen Filzschreiber am unteren Ende des
Streifens in 2 cm Höhe einen dicken Strich, der aber nicht an den Papierrand
kommen darf. Mit einem Bleistift notieren wir die Farbe auf dem Papier und
hängen dann das Blatt in das Glas. Es darf unten nicht den Boden berühren,
sondern muss frei hängen.
Nun gießen wir vorsichtig etwas Wasser ins Glas. Die Menge ist so zu bemessen,
dass der Papierstreifen gerade Kontakt mit dem Wasser hat. So vermeiden wir den
Hauptfehler bei diesem Versuch: Der Farbstrich darf nicht ins Wasser hängen, da
sich sonst die Farben herauslösen.
Wir erkennen nun, dass der Streifen Wasser ansaugt, das in ihm aufsteigt. Mit
dem aufsteigenden Wasser wandern auch die Farbstoffe mit.
Wenn die Wasserfront nahe beim Hölzchen ist, nehmen wir die Papierfahne heraus
und trocknen sie.
3. Chromatogramm künstlerisch
Zerlegen der Farbe von schwarzem Filzstift: http://www.haus-der-kleinen-forscher.de/de/forschen/praxisideen-experimente/wasser/experiment-detail/experiment/zeige/detail/das-geheimnisvolle-schwarz/
Also rundes Filterpapier als Grundlage. In die Mitte eine Filzstiftfarbe. Wasser aus der Pipette drauf. testweise auch mal Alkohol, gar Aceton. Nach außen verlaufen lassen. Die "Farb-Gruppe" soll testen, mit welchem Filzstift und welcher Menge von welchem Lösungsmittel sie beeindruckende "Verlaufskunst" erstellen kann, und das den andern vorführen.
4. Sieben farblose Lösungen werden bunt
http://www.versuchschemie.de/ptopic,33052.html
Geräte:
7 Bechergläser (250 ml)
6 Bechergläser (1000 ml)
Glasstäbe
7 Tropfpipetten
Waage.
Chemikalien:
Eisen(III)-chlorid
Kaliumhexacyanoferrat(II)
Kaliumhydrogensulfat
Kaliumthiocyanat
Methanol - das ist ein Atemgift. Arbeiten Sie nahe am Fenster.
Natriumcarbonat - das hat die Tensidgruppe. Leihen Sie es aus
Natriumfluorid
Phenolphthalein - das hat die Indikatorgruppe. Leihen Sie es aus.
dest. Wasser.
Sicherheitshinweise:
Kaliumhydrogensulfat und Natriumcarbonat wirken reizend, Eisen(III)-chlorid
sowie Kaliumthiocyanat sind gesundheitsschädlich, Natriumfluorid ist giftig und
reizend, Methanol ist leichtentzündlich und giftig. Das Tragen einer
Schutzbrille ist erforderlich.
Versuch:
Folgende Lösungen werden hergestellt:
Lösung 1: 5 ml Phenolphthalein-Lösung holen Sie sich von der
Indikatorgruppe
Lösung 2: 50 mg Natriumcarbonat in 10 ml dest. Wasser
Lösung 3: 1,5 g Eisen(III)-chlorid in 10 ml dest. Wasser
Lösung 4: 500 mg Kaliumthiocyanat in 10 ml dest. Wasser
Lösung 5: 1,5 g Natriumfluorid in 10 ml dest. Wasser DAS FEHLT. Auch KF
war nicht zu finden. Wir suchen!
Lösung 6: 1,2 g Kaliumhydrogensulfat in 10 ml dest. Wasser
Lösung 7: 80 mg Kaliumhexacyanoferrat(II) in 10 ml dest. Wasser
Damit kann der Versuch einmal geübt werden, und einmal wird er dann der Klasse
gezeigt.
Eine zweite Reihe mit von A-F gekennzeichneten
Reagenzgläsern werden wie folgt gefüllt:
Reagenzglas A: 2,5 ml von Lösung 1 (Phenolphthaleinlösung)
Reagenzglas B: 5 ml von Lösung 2 (Natriumcarbonatlösung)
Reagenzglas C: 5 ml von Lösung 3 (Eisen(III)-chloridlösung)
Reagenzglas D: 5 ml von Lösung 4 (Kaliumthiocyanatlösung)
Reagenzglas E: 5 ml von Lösung 5 (Natriumfluoridlösung)
5 ml von Lösung 6 (Kaliumhydrogensulfatlösung)
Reagenzglas F: 5 ml von Lösung 7 (Kaliumhexacyanoferrat(II)-lösung)
Zur Vorführung füllt man Becherglas A demonstrativ mit 2,5 ml dest. Wasser und
füllt den Inhalt von Becherglas A in Becherglas B. Der Inhalt von Becherglas B
wird in Becherglas C gegeben. Den Inhalt in Becherglas C füllt man in Becherglas
D....
Nach jedem Umgießen ändert sich die Farbe der jeweiligen Lösung: Die
Anfangslösung im Becherglas ist farblos, danach folgen Farbumschläge nach
farblos, rotviolett, gelb, rot, farblos und anschließend tiefblau.
Erklärung (diese Erklärungen sind vom Lehrer nicht korrigiert und werden
in keiner Klausur gefragt. Sie stehen nur ergänzend hier):
Das schwach basische Millieu, welches sich aus der
Hydrolyse von Natriumcarbonat ergibt, färbt das farblose Phenolphthelein wegen
der pH-Wert-Änderung rotviolett:
CO32- + H2O ---> HCO3- + OH-
Das Hexaaquaferration reagiert als Kationsäure zu gelben Pentaaquahydroxy- und
Tetraaquadihydroxyferrat-Ionen. Wegen der simulatanen pH-Wert-Änderung entfärbt
sich das Phenolphthalein:
[Fe(H2O)6]3+ + H2O ---> [Fe(OH)(H2O)5]2+ + H+
Der Pentaaquahydroxyferratkomplex reagiert mit Kaliumthiocyanat zu einem rotem
Thiocyanatkomplex:
[Fe(OH)(H2O)5]2+ + 3 SCN- ---> [Fe(SCN)3(H2O)3] + 2 H2O + OH-
Der rote Thiocyanatkomplex wird durch Natriumfluoridzugabe entfärbt:
[Fe(SCN)3(H2O)3] + 6 F- ---> [FeF6]3- + 3 H2O + 3 SCN-
Der gebildete Hexafluorokomplex wird bei Zugabe von Kaliumhexacynoferrat unter
Bildung von Berliner Blau zerstört:
4 [FeF6]3- + 3 [Fe(CN)6]4- ---> Fe4[Fe(CN)6]3 + 24 F-
Entsorgung:
Die blaue Lösung im letzten Becherglas kann stark verdünnt über das Abwasser
entsorgt werden.
5. Tipp:
Vor 12 Jahren hat ein Schüler ein
etwas bunt gestaltetes Referat über Farben ins Internet gestellt:
http://www.mennel.net/chemiereferate/farben.htm