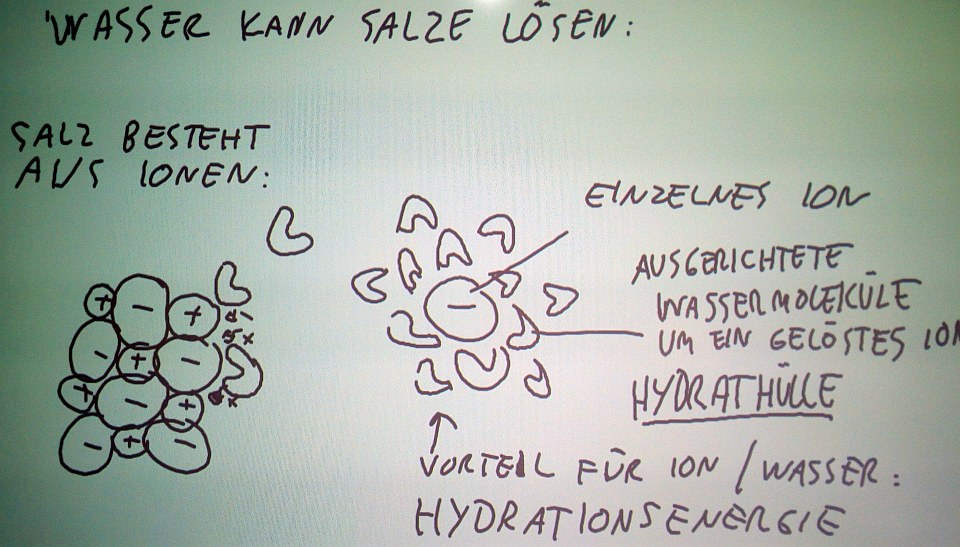
|
Inhalte aus "Wasserchemie" im Eingstiegskurs Chemie am 16.4.2019
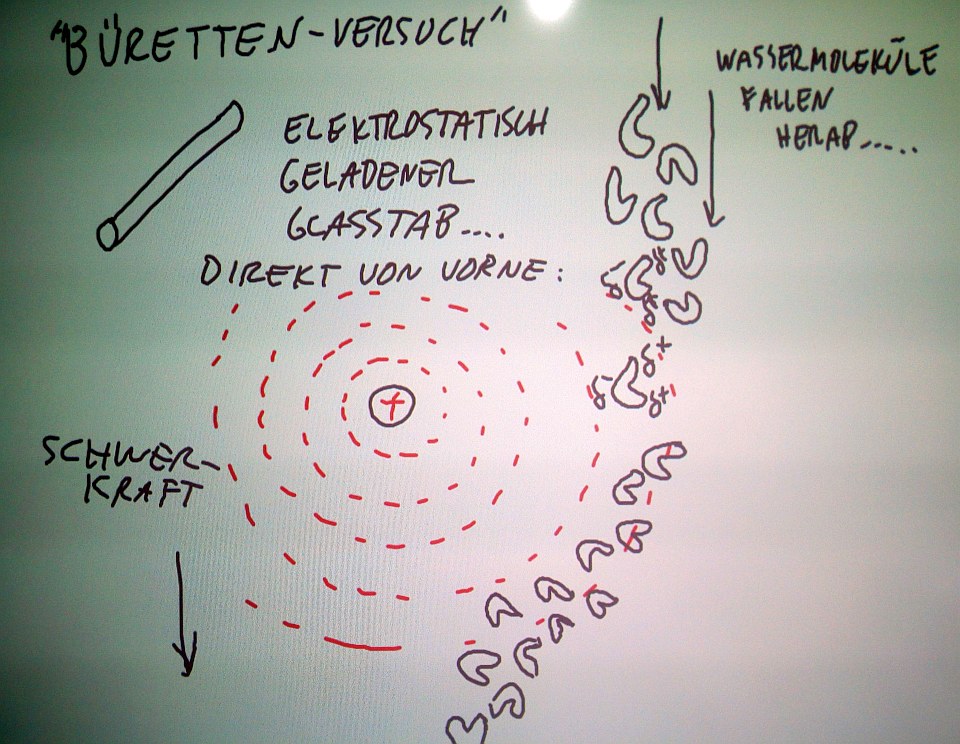
Oben: Dieser Versuch wird auf der Vorbereitungsseite angekündigt mit "Wasser in einem elektrostatischen Feld"
Oben: Sechs Stoffe aus dem Alltag,
die sich in Flüssigkeiten farblos lösten, konnten wir mit
Flüssig-Universal-Indikator gut in ihrem PH-Wert sichtbar machen. Rot ist
sauer. Bei Blaugrün wird es basisch.
Oben: Um den PH-Wert von Flüssigkeiten mit eigener Farbe zu ermitteln, gibt es Indikator-Papier. Wir testen mit einem batteriebetriebenen PH-Meter. Und lernen dann auch gleich einen "Puffer" kennen. Dazu geben wir Säure oder Base vergleichend tropfenweise in Wasser und Puffer und schauen uns die PH-Änderung an. |