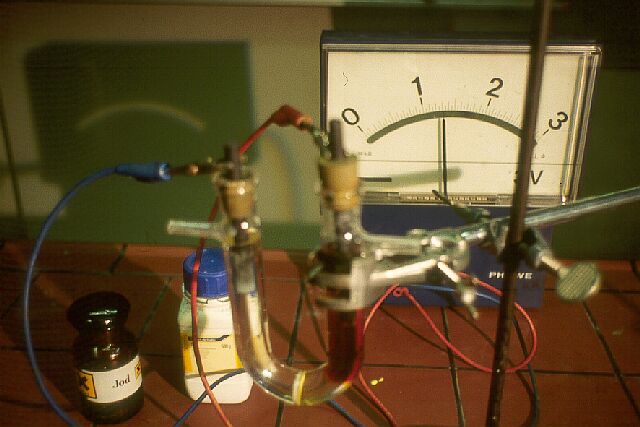|
Hier ist ein frühes Fotoprotokoll des Versuches von http://www.mennel.net/chemieeinstieg/chzinkel.htm . Da sind Aufbau und Ablauf noch kaum verständlich. Deshalb dokumentieren wir den Versuch nochmals.
Der erste Schritt: Eine klare Lösung des Salzes Zinkdijodid (gebildet aus dem
Jodvulkan, oder
schmuckloser, indem man ein Gemisch aus Zink und Jod mit Wasser überschüttet)
wird in einem U-Rohr mit Glasfritte einem Gleichstrom ausgesetzt - 20 V, ein
paar Ampere. Die Theorie hat eine Schülerin mal notiert: http://www.mennel.net/chemieeinstieg/chpauk2.htm |
Der zweite Schritt: Die Gleichstromquelle wird abgeschaltet und entfernt. Beide Pole des U-Rohrs - an einem hat sich graues Zink abgelagert, um den anderen Pol schweben Jodmoleküle im Wasser - werden stromleitend miteinander verbunden. Ein Amperemeter zeigt an, was nun passiert: Strom fließt "von selbst", das elektronegativere Jod holt sich Elektronen vom Zink. Über Stunden hinweg bildet sich aus den Elementen wieder das Salz: Applaus! Wir haben eine Zink/Jod-Batterie hergestellt. Lehrerkollegen haben sich da auch schon bemüht: http://www.hamm-chemie.de/k10/k10ab/84.pdf |