Referat von Andreas rings um die Analyse von Zinkdijodid
|
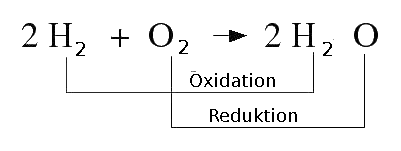
Elektrischer Strom: Als elektrischen Strom bezeichnet man die Gesamtheit der elektrischen Erscheinungen z.B. die Ursache eines Magnetfeldes. Das bedeutet sobald sich Ladungsträger, also Elektronen oder Protonen in einem Stoff (meistens Metalle) fliesen gibt es einen elektrischer Strom. Oft ist mit Strom die physikalische Größe, also die Stromstärke mit der Einheit Ampere gemeint. Redoxreaktion: Das ist eine chemische Reaktion bei der Elektronen von einem Stoff auf einen Reaktionspartner übertragen werden. Dabei findet eine Elektronenabgabe (Oxidation) sowie eine Elektronenaufnahme (Reduktion) statt. Redoxreaktionen haben eine Grundlegende Bedeutung in der Chemie, Stoffwechsel-, Verbrennungs-, Produktionsprozessen und Nachweisreaktionen basieren auf solchen Elektronenübertragungsreaktionen. Hier eine einfache und grundlegende Redox-Gleichung der Chemie: Wasserstoff reagiert mit Sauerstoff - dieses "Knallgasgemisch" verbindet sich exotherm zu Wasser. Anfangs sind die beiden Element im neutralen Zustand. Im Wasser dann ist der Wasserstoff oxidiert (jedes H-Atom hat je 1 Elektron an den Sauerstoff abgegeben), der Sauerstoff hat den Wasserstoff oxidiert und wurde dabei selbst reduziert (er hat zwei Elektronen aufgenommen):
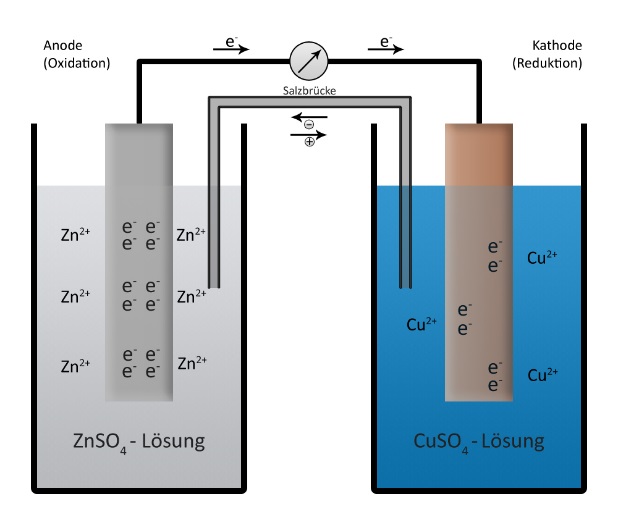
Batterie: Eine Batterie ist eine Aneinanderreihung von vielen einzelnen galvanischen Zellen. In einer galvanischen Zelle wird spontan chemische Energie in elektrische Energie umgewandelt. Eine galvanische Zelle beruht auf dem Vorgang einer Redoxreaktion. Oxidation und Reduktion laufen in räumlich getrennten Orten statt, je in einer Halbzelle. Über einen Ionenleiter und einen Elektronenleiter wird der Stromkreis geschlossen. Dadurch entsteht elektrischer Strom.
Die Grafik zeigt einen allgemeinen chemischen Versuch zum Prinzip der Batterie. Links das Zink können wir für unseren Versuch übernehmen. Rechts aber war Jod, nicht Cu-Ionen, und die Lösung enthält bei uns auf beiden Seiten der Batterie ZnJ2 und nicht CuSO4 . |
Zinkdijodid Eigenschaften: Zinkdijodid lässt sich sehr leicht in Wasser lösen. Es löst sich auch in Ethylalkohol und Diethylether, zwar etwas schlechter aber immer noch gut. In reinem Zustand ist Zindijodid weiß aber unter Lichteinwirkung und Feuchtigkeit färbt es sich leicht gelb. Dieser Stoff verhält sich hygroskopisch, das heißt er zieht das Wasser an, z.B den Wasseranteil der sich in der Luft befindet. Wenn man eine Gleichspannung anlegt zerlegt sich der Stoff in seine einzelnen Elemente. Am Pluspol bildet sich durch diese Elektrolyse das elementare Iod (Oxidation). Am Minuspol sammelt sich das Zink (Reduktion=.
Redoxreaktion Zn2+ + 2I- --> Zn + I2 Herstellung: Durch das Mischen einer Spatelspitze Iod mit einer Spatelspitze Zink und wenig Wasser gelingt die Synthese (Achtung Iod-Dämpfe). Bei starker Wärmeentwicklung verschwindet die Färbung (schwarzgrau) des Iods. Durch das Filtern und Eindampfen erhält man nun einen weißen salzartigen Rückstand von Zinkdijodid. Verwendung:
Zinkdijodid
einigt sich hervorragend für die modellhafte Darstellung einer Elektrolyse. Da
dieses Salz gut Röntgenstrahlen absorbiert, wird es als Kontrastmittel bei der
Röntgendiagnostik von Werkstoffen eingesetzt. Was geschieht, wenn man Jod mit Zink mischt? Es findet
eine Redoxreaktion der beiden Stoffe statt, das Ergebnis dieser Reaktion ist
Zinkdijodid und Energie. "Elektrolyse ist eine erzwungene Redox-Reaktionen durch elektrischen Strom"... und unsere Eletrolyse erweist sich sogar als reversible Redoxreaktion": Das bedeutet, die Reaktion kann wieder umgekehrt werden. Praktisch ist das auf dieselbe Art und Weise aber meistens nicht möglich. Für die Umkehr der Reaktion muss meist ein Umweg gegangen werden. |