Indikatoren sind Farbstoffe, die verschiedene Farben annehmen je nach PH-Wert.
Der PH-Wert ist eine Ziffer zwischen 0 und 14, die sagt, wie sauer (bis 0) oder basisch (bis 14) eine Flüssigkeit ist. Der PH-Wert ist auf Wasser bezogen: Wasser hat den PH-Wert 7, in der Mitte zwischen 0 und 14, und ist neutral.
Alle Indikatoren sind organische Substanzen mit abenteuerlichen Formeln. Denn es geht erstens darum, dass sie überhaupt Farben zeigen - das ist ja eigentlich eine Ausnahme unter den Stoffen. Und dann sollen sie auch noch bei einer Änderung der Hydronium-Ionen-Konzentration ihre Farbe verschieben.
Die Hydronium-Ionen im Wasser sind die Stoffe, auf die der PH-Wert sich bezieht: Wenn das Wasser so viele Hydronium-Ionen hat, wie es überhaupt in sich tragen (= "lösen") kann, hat es PH 0. Dann befindet sich 1 Mol Hydronium-Ionen in 1 Liter Wasser - mehr geht nicht. Umgekehrt sind bei PH 14 alle Hydronium-Ionen aus dem Wasser verschwunden - dann ist auch Schluss mit der PH-Skala. Beim PH-Wert 7 sind 10-7 Mol Hydronium-Ionen in einem Liter Wasser enthalten.
Ein Hydronium-Ion ist ein Wasser-Molekül, an das sich ein zusätzliches Proton gebunden hat. Dieses "Proton" entspricht einem Wasserstoff-Atom ohne sein eines Elektron. Es ist positiv geladen. Ein durch das Proton positiv geladenes Hydronium-Ion ist keine feststehende Verbindung, sondern ein statistisches Ereignis: Bei PH-Wert 5 z.B. sind im Wasser stetig 10-5 Mol Protonen unterwegs, die sich an 10-5 Wassermoleküle anlagern. Wenn man Wasserstoffbrücken-Bindungen zwischen zwei Wassermolekülen erklärt, dann zeichnet man den Moment, in dem ein kurzlebiges Hydronium-Ion sich bildet.
Bei einem Indikator muss eine bestimmte Menge Hydronium-Ionen im Wasser bewirken, dass der Indikator seine Formel ändert. Wenn ein Indikator durch umgebende Protonen so "protoniert" wird, dass die Formel sich ändert, zeigt er eine Farbänderung.
Hier sehen wir, wie ein Baustein im Lackmus je nach den Protonenangebot im Wasser ein negativ geladenes Phenolat-Ion ist (am Anfang und am Schluss), oder ein neutrales Phenol-Molekül:
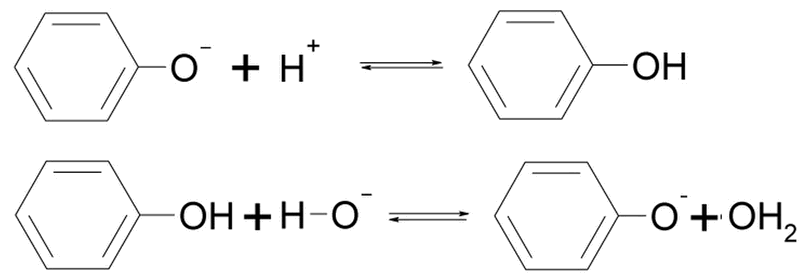
H-O- - Ionen heißen Hydroxidionen. Sie sind in Basen mehr vorhanden als Hydroniumionen. In der oberen Zeile des Bildes beginnen wir also mit einer Säure - da gibt es H+ = Protonen, und in der unteren Zeile trifft das Phenol auf eine Base.
Der ganze Lackmus-Farbstoff ist umfangreicher gebaut: 7 Ringe und zahlreiche Stellen mit OH-Gruppen (= Hydroxylgruppen):
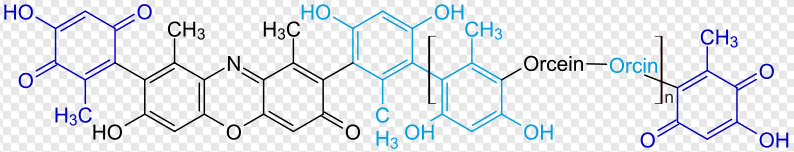
Hübsche Kunstwerke der Chemie sind auch die andern Indikatoren: Bromthymolblau
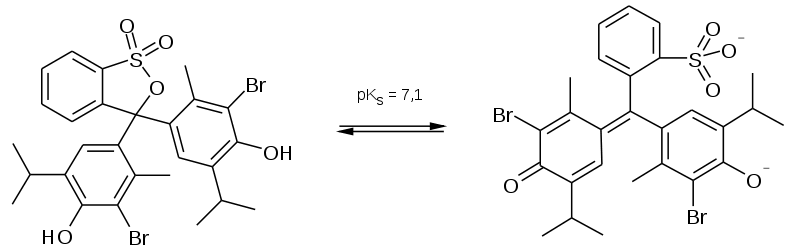
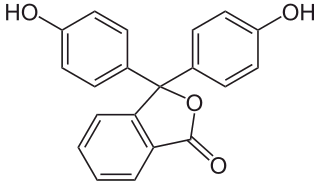
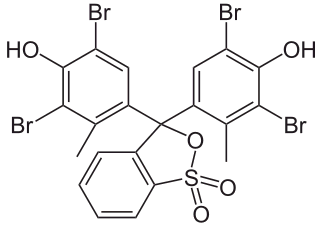
Phenolphthalein und Bromkresolgrün (Beides sind vier ähnlich arrangierte Ringe, aber dann mit wesentlichen Unterschieden):
|
|
|
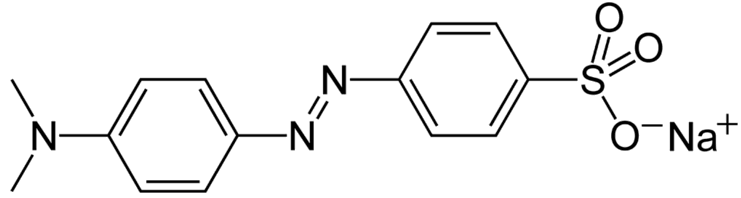
Methylorange:
Und auch hier wieder ein im Bau verwandter, farblich aber anders sich verhaltender Indikator "Alizaringelb":
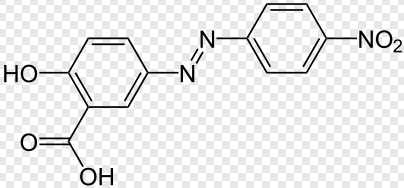
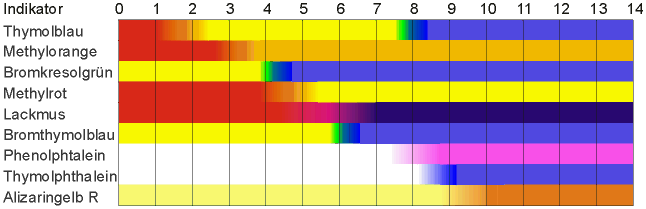
Die hier genannten Indikatoren zeigen
folgende Farben je nach PH-Wert: