|
Elena: Feuerwerksfarben - welche Substanzen liefern sie? Einerseits wird Ihnen von der Schule eine leichte Show
geboten: An einem Bunsenbrenner trainieren Sie mit Magnesia-Stäbchen, die
Bunsenbrennerfarbe anders als gelb zu bekommen. „Gelb“ schafft man immer -
schon winzige Mengen von Natrium reichen da. Beispielsweise kann es reichen,
dass Sie das Magnesia-Stäbchen mit der Hand anfassen und diesen Bereich in
die Flamme halten: Gelb... Die Bunsenbrennerflamme lässt sich zumeist farblos regulieren. Spielen Sie da mit der Gasmenge und der Luftzufuhr herum, bis sie durchsichtig ist. Sollte das nicht klappen, wechseln Sie den Bunsenbrenner. Wenn Sie in dieser Flamme mehrere Farben zeigen können, haben Sie schon mal etwas zum Zeigen. Es geht nun andererseits darum, eine dauerhaftere Flammenfärbung zu erzeugen. Ihnen stehen ein Dutzend Kerzen zur Verfügung. Das Kerzenlicht enthält allerdings immer Rußteilchen, die es teilweise gelb färben. Lässt sich durch Einstreuen von Metallen hier eine Einzelreaktion des Feuerwerkes zeigen? Probieren Sie, von kleinsten Mengen steigern, mit Aluminum, Magnesium, Eisen und schließlich den typisch bunt färbenden Salzen hier besondere Flammen zu erzeugen. Aus http://www.pyro-partner.de/Feuerwerk/Feuerwerk-Chemie.html ein Überblick: Eine Flamme kann man durch die Salze von Metallen wie: Natrium (Gelb), Barium (Grün), Strontium (Rot),Kalium (Violett), Kupfer (Blau) färben. Alle Farben außer Blau lassen sich einfach erzeugen. Man verwendet das Nitrat des entsprechenden Metalls. Der Einsatz von Kupfernitrat erzeugt allerdings keine blaue Farbe in pyrotechnischen Mischungen. Um Blau zu erzeugen, muss man verschiedene Kupfersalze in der selben Mischung verwenden und genaue Mengen organischer Chlorverbindungen zufügen. Die blaue Färbung entsteht nur dann, wenn während des Verbrennens neben Kupfer auch Chlor vorhanden ist. In diesen Mischungen herrscht ein feines Gleichgewicht vor, dass man nicht errechnen kann. Man kann es nur durch Versuche erreichen! ALUMINIUM Al – Brennstoff BARIUMNITRAT Ba(NO3)2 – Oxidationsmittel, giftig. Grüner Farbgeber. CALCIUMCARBONAT CaCO3 – Orangeroter Farbgeber. CALCIUMSULFAT CaSO4 – Außer in Chloratsätzen für orangerote Blinkeffekte und Leuchtsterne. EISEN Fe – Brennstoff |
HOLZKOHLE C – Brennstoff Wird als Hauptbestandteil von Schwarzpulver verwendet. Die Qualität und Herkunft der Holzkohle ist entscheidend für die Qualität von Schwarzpulver. Sehr fein gepulverte Holzkohle wird für Schwarzpulver und etwas gröberes Pulver für lange Funken benötigt. KALIUMCHLORAT
KClO3 – Starkes Oxidationsmittel KALIUMNITRAT KNO3 – Oxidationsmittel KUPFERCARBONAT BASISCH CuCO3 * Cu(OH)2 – Giftig. - Grünliches Pulver. Blauer Farbgeber. KUPFERCHLORID CuCl, CuCl2 – Farbgeber – Giftig - Hygroskopisch. Grünliches Pulver. Blauer Farbgeber. KUPFEROXID CuO, Cu2O – Mindergiftig - Schwarzes oder rotes Pulver. Blauer Farbgeber. LITHIUMCARBONAT Li2CO3 – Weißes Pulver. Roter Farbgeber. MAGNESIUM Mg – Brennstoff NATRIUMHYDROGENCARBONAT (NATRON) NaHCO3 – Gelber Farbgeber. NATRIUMNITRAT NaNO3 – Oxidationsmittel – Gelber Farbgeber Ähnlich wie Kaliumnitrat, aber stark hygroskopisch. Wird zusammen mit Kaliumperchlorat in Pfeifsätzen verwendet. POLYVINYLCHLORID (PVC) – Farbverbesserer SCHWEFEL S – Brennstoff STRONTIUMNITRAT Sr(NO3)2 – Oxidationsmittel – Farbgeber- Hygroskopisch, ähnlich Kaliumnitrat. Roter Farbgeber. ZINK Zn – Brennstoff |
Wie entstehen die Farben des Feuerwerks?
Grundsätzlich unterscheidet sich eine normale Verbrennung nur wenig von der eines pyrotechnischen Satzes. Dennoch gibt es Unterschiede, beispielsweise die Verbrennungsgeschwindigkeit oder auch die Komplexität, in der die Reaktionen ablaufen. Die Chemikalien, die in den Sätzen der Feuerwerkerei Verwendung finden, lassen sich in drei Gruppen einteilen. Erstens die Oxidationsmittel, zweitens die Brennstoffe und drittens die Zusatzstoffe (z.B. Farbgeber, Bindemittel, Katalysatoren). Oxidationsmittel: Oxidationsmittel machen das Geheimnis pyrotechnischer Sätze aus. Sie sorgen dafür, dass die Feuerwerkssätze unabhängig vom Luftsauerstoff reagieren können, indem sie den Sauerstoff für die Verbrennung zur Verfügung stellen.
Brennstoffe: Der Brennstoff hat die Aufgabe, während der Reaktion in Verbindung mit einem Oxidationsmittel für eine hohe Temperatur zu sorgen. Eine hohe Temperatur ist dafür notwendig, dass z.B. farberzeugende Stoffe zum Leuchten angeregt werden. Je höher die Temperatur, desto größer ist auch die Lichtausbeute. Beispiele für Brennstoffe sind: Metalle, wie Magnesium, Titan oder Eisen; Nichtmetalle, wie Schwefel oder Kohlenstoff und organische Verbindungen, wie Schellack oder PVC. Bei den Brennstoffen und den Oxidationsmitteln sollte man allerdings auf das chemische Gleichgewicht achten. D.h. in einer Mischung darf nicht mehr sauerstoffliefernde Substanz vorhanden sein, als zur Verbrennung der brennbaren Substanz nötig ist, da ein solcher Überschuss die Reaktion behindern würde. Einen großen Einfluss auf das Gelingen der Reaktion hat auch die Partikelgröße. Bei der Feuerwerksmischung Grün kommt die heftige Reaktion nur zustande, wenn man mit Zinkpulver arbeitet. Bei Einsatz von Zinkbrocken würde die Reaktion nur sehr langsam und weniger exotherm ablaufen. Je feiner das Pulver ist, desto größer ist seine Oberfläche und desto besser kann es reagieren. Quellen: http://daten.didaktikchemie.uni-bayreuth.de/experimente/effekt/effekt_feuerwerkeh.htm https://de.wikipedia.org/wiki/Flammenf%C3%A4rbung http://de.wikihow.com/Farbiges-Feuer-machen https://de.wikibooks.org/wiki/Praktikum_Anorganische_Chemie/_Flammenf%C3%A4rbung |
Flammenfärbung: Eine Flamme kann durch Zugabe von Metallsalzen eingefärbt werden. Verwendet wird:
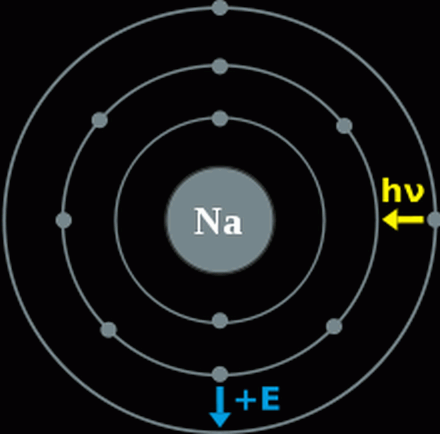
Erklärung der Flammenfärbung: Alle Elemente senden bei hohen Temperaturen Licht aus. Doch für Elemente, die eine Flammenfärbung aufweisen, geschieht dies schon bei den Temperaturen, die in einer Flamme herrschen. Die Elektronen eines Atoms werden durch Zufuhr von Wärmeenergie (die in diesem Fall durch eine Verbrennung entsteht) auf ein vom Atomkern weiter entferntes Energieniveau – in einen angeregten Zustand – gehoben. Diese Elektronen besitzen nun eine höhere potentielle Energie. Die negativ geladenen Elektronen fallen aber meist in Sekundenbruchteilen wieder auf das energieärmere Ausgangs-Energieniveau zurück. Die beim Zurückfallen frei werdende Energie wird als Photon (Lichtteilchen) abgegeben. Man spricht von einem Quant. Es ist durch eine genau definierte Energie und somit auch mit einer einzigen Wellenlänge gekennzeichnet. Das Zurückfallen der Elektronen auf energieärmere Energieniveaus kann auch stufenweise erfolgen. Bei jedem Zurückfallen dieses Elektrons auf ein energieärmeres Energieniveau gibt es nun Licht einer ganz bestimmten Wellenlänge (Farbe), und damit einer ganz bestimmten Energie, ab.
Valenzschalenmodell des Natrium mit pendelndem Elektron Flammenfärbung als Analyse: Die Flammenfärbung wird in der Chemie auch als Analyse von chemischen Elementen oder deren Ionen genutzt. Elemente oder Ionen geben in einer farblosen Flamme Licht in einer spezifischer Wellenlängen ab, das für jedes Element charakteristisch ist. Bei der Flammenfärbung wird die Stoffprobe meist einfach auf einem Platindraht oder einem Magnesiastäbchen in die farblose Flamme eines Bunsenbrenners gehalten. Aufgrund der Farbe kann nun auf die Ionen in der Probe rückgeschlossen werden, allerdings überdeckt die sehr intensive gelbe Flammenfärbung des Natriums oft alle anderen Flammenfärbungen. Die Flammenfärbung ist eine Vorprobe für viele Kationen und besonders bei Alkali- und Erdalkalimetallen zum Nachweis geeignet. |