Ellen: Versuch der Herstellung von Estern mit der Komponente Hexansäure
|
1. Was ist Hexan? Hexan ist eine farblose und leicht flüchtige Flüssigkeit, die etwas nach Benzin riecht. Sie kann schon bei Raumtemperatur verdampfen. Dabei bilden sich Gasgemische in der Luft. Da Hexandämpfe schwerer als Luft sind, breiten diese sich am Boden aus. Das Alkan verbrennt mit schwach rußender Flamme. Es ist in Wasser nicht gut löslich, aber in organischen Lösungsmitteln wie Ethylalkohol, Ethol (eine Entwicklerflüssigkeit für Schwarzweißfilm), Chloroform und Benzin gut löslich. Fette und Öle lösen sich auch gut in Hexan. Hexan ist ein gesättigtes Kohlenwasserstoff und hat fünf Isomere, also fünf unterschiedliche Strukturen. Verwendung: Hexan wird in der organischen Chemie als Lösungsmittel eingesetzt. Es ist ein universelles Lösungsmittel und Extraktionsmittel. Hexan wird häufig als Verdünnungsmittel in Lacken, Druckfarben oder Klebstoffen eingesetzt. Dort kann es als Schnüffelmittel missbraucht werden. Hexan und Ethylalkohol dienen auch als Quecksilberersatz in Thermometern. Viele organische Lösungsmittel greifen Polystyrol an, Hexan aber nicht. Darum wird es als Solvens (Lösungsmittel) für Styroporkleber verwendet. Herstellung: Wird Erdöl fraktioniert destilliert, findet man Hexane in der Fraktion der Leichtbenzine. Um Hexan aus dieser Fraktion extrahieren, muss man diese erneut destillieren. Gefahren: Hexan kann süchtig machen und ist gesundheits- und
umweltschädlich. Es ist wassergefährdend und kann auch explosive Gemische
bilden. Im Körper wird Hexan zu 2,5-Hexandion metabolisiert. Es führt zu
Nervenschäden und wird über den Urin ausgeschieden. 2. Was ist Hexansäure? Capronsäure (n-Hexansäure) C 5H11-COOH ist eine gesättigte Fettsäure, die sich vom n-Hexan ableitet. Bei Zimmertemperatur ist es eine farblose, ölige und übelriechende Flüssigkeit. Am häufigsten kommt es als Fettsäure zu 2-3 Prozent in der Milch vor. Es dient zur Synthese von Fruchtaromen durch Veresterung. Die Salze und Ester heißen Capronate oder Hexonate.Der Name Capra leitet sich von „capra“ lat. für „Ziege“ ab,
da deren Geruch an Capronsäure erinnert. 3. Was ist Hexanol? Es ist eine klare, farblose Flüssigkeit mit süßlichem Geruch und leicht brennbar. In 175 ml Wasser löst sich nur 1ml Hexanol. Es ist also schwer wasserlöslich. Hexanol ist ein Alkanol (Alkohol) in der organischen Chemie. Die Summenformel des kettenförmigen und unverzweigten Alkohols, das n-Hexanol, lautet C 6H13OH.Es gibt fünf weitere Isomere des Hexanols. Hexanol wird als Lösungsmittel für Kohlenwasserstoffe, Leinöl, Hormone und viele Harze eingesetzt. Es dient auch als Zwischenprodukt bei der Herstellung von Tensiden, Weichmachern und Insektenabwehrmitteln. Hexan-1,2,3,4,5,6-hexol wird bspw. zu Eiskonfekt
hinzugegeben. Daher kommt die kühlende Wirkung. Es ist auch ein
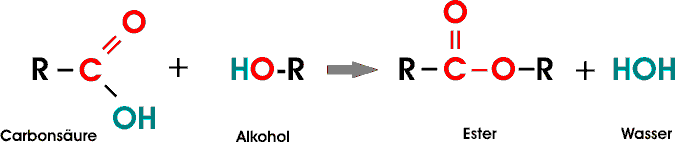
Süßungsmittel von Diabetikerprodukten. 4. Wie entsteht ein Ester? Ein Ester entsteht, wenn eine Säure mit einem Alkohol oder Phenol unter der Abspaltung von Wasser reagiert. Eine Reaktion, bei der ein kleines Molekül - wie beispielsweise Wasser - abgespalten wird, nennt man Kondensationsreaktion. Bei Carbonsäureester reagieren Carbonsäure und Alkohol in einer Kondensationsreaktion zu Ester und Wasser. Die Carboxylgruppe der Säure verbindet sich mit der Hydroxylgruppe des Alkohols. Wasser wird abgespalten und die Moleküle verknüpfen zu einer Estergruppe. Carbonsäureester kommen in der Natur vor allem in Früchten, Fetten und Ölen vor. Sie werden als Aroma- und Duftstoffe eingesetzt. Ein bekannter Salpetersäureester aus Glycerin und Salpetersäure ist der Sprengstoff Nitroglycerin. Bei der Schießbaumwolle ist Cellulose mit Salpetersäure verestert. Hexansäureethylester entsteht z.B. bei Gärungsprozessen und kommt so z. B. in Bier[5], Wein[6] und Fruchtsäften aus Zitrusfrüchten vor. Langkettige Schwefelsäureester werden als Fettalkoholsulfate
bezeichnet und kommen in Waschmitteln vor. 5. Welche Rolle spielt die Schwefelsäure bei der Veresterung? Die Esterreaktion ist eigentlich eine Gleichgewichtsreaktion mit geringer Reaktionsgeschwindigkeit, sodass der Ester erst nach Tagen entsteht. Starke Säuren, so wie die hochkonzentrierte Schwefelsäure, dienen als Katalysator und beschleunigen so die Reaktion. Es ist ein komplizierter Reaktionsmechanismus. Das Proton der Schwefelsäure greift am Sauerstoffatom der Doppelbindung im Essigsäure-Molekül an. Am Ende wird durch verschiedene Umbauten das Wasser abgespalten und der Katalysator zurückgebildet. Die klassische Estersynthese ist eine Säurekatalyse. Säuren katalysieren also nicht nur die Synthese, sondern auch die Esterspaltung. Die Schwefelsäure sorgt als hydroskopischer Stoff dafür, dass das Wasser aus dem Estergleichgewicht entfernt wird und so eine Gleichgewichtsverschiebung erfolgt. Schwefelsäure wird dabei mit der Zeit verdünnt und unbrauchbar. (Fraglich ob Schwefelsäure dann dennoch ein Katalysator ist, da es zwar einerseits beschleunigt, am Ende aber verändert aus der Reaktion hervorgeht). Manche Ester zerfallen unter Wassereinfluss in ihre Säure-
und Alkoholkomponenten. Dies wird als hydrolytische Spaltung oder auch
Verseifung bezeichnet und stellt den entgegengesetzten Vorgang zur
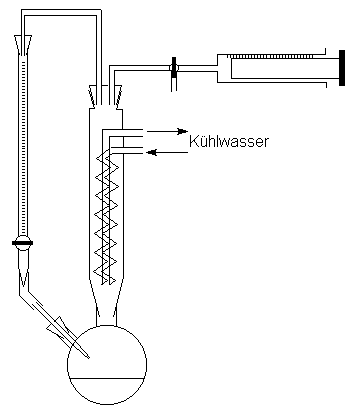
Veresterung dar. 6. Die Herstellung von Estern für Lebensmittel ohne die Hilfe von Säuren. Veresterungsreaktionen finden auch ohne die katalytische Funktion von Säuren statt, laufen dann allerdings viel langsamer ab. Man mischt in der Lebensmittelchemie die Ausgangsstoffe, heizt sie bis zum Verdampfen und kühlt sie wieder zur Flüssigkeit. Bei Bedarf geschieht das einen ganzen Tag lang im Kreis herum. Die Bildung der Ester erkennt man im einfachsten Fall an der Bildung einer hydrophoben Phase im Gemisch. Das verwendete Gerät heißt "Rücklaufkühler". 18.10.2015 |
Hier auf der rechten Seite gibt es Bilder zum Text
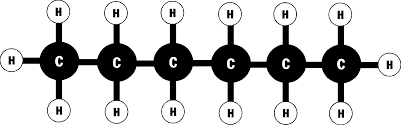
links Hexan, Strukturformel:
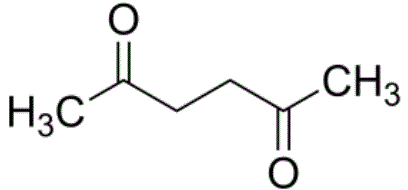
................................ Hexandion - das macht der Körper aus Hexan, wenn es in ihm auftaucht:
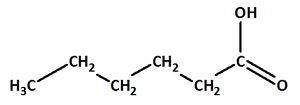
.................................. Hexansäure:
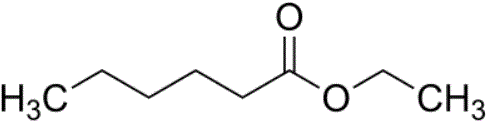
................................. Hexansäure-Ethyl-Ester:
................................ Oben sind verschiedene "Strukturformeln" zu sehen. Dabei werden im Prinzip die Orte der Atomkerne durch Striche miteinander verbunden. Man kann Moleküle auch als "Kalottenmodell" abbilden. Dann sieht man, welchen Raum sie einnehmen. Hier das Kalottenmodell von Hexanol:
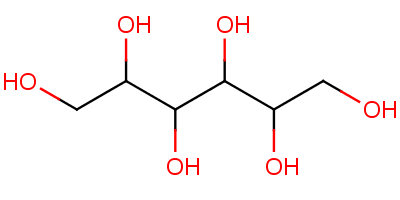
............................. Sorbit, ein Süßungsmittel für Diabetiker, ist Hexan-1,2,3,4,5,6-hexol:
......................................... Alkanol + Säure = Ester:
................................ Auf Fotos des Gerätes bleibt es oft schwer verstehbar.
Deshalb hier die Zeichnung eines Rückflusskühlers:
|